免疫印迹(WB)实验指南
发布时间:2023-12-07
各位科研小伙伴们,是不是又在为Western Blot实验抓狂?今天这篇推文,就带你解锁WB实验的“防翻车秘籍”,从蛋白提取到结果分析,手把手教你避开那些让人头秃的坑!
首先,我们来回顾下整个 WB 流程:蛋白样本制备 → 电泳 → 转膜 → 封闭 → 孵育一抗 → 孵育二抗 → 显影 → 分析。如下图所示:
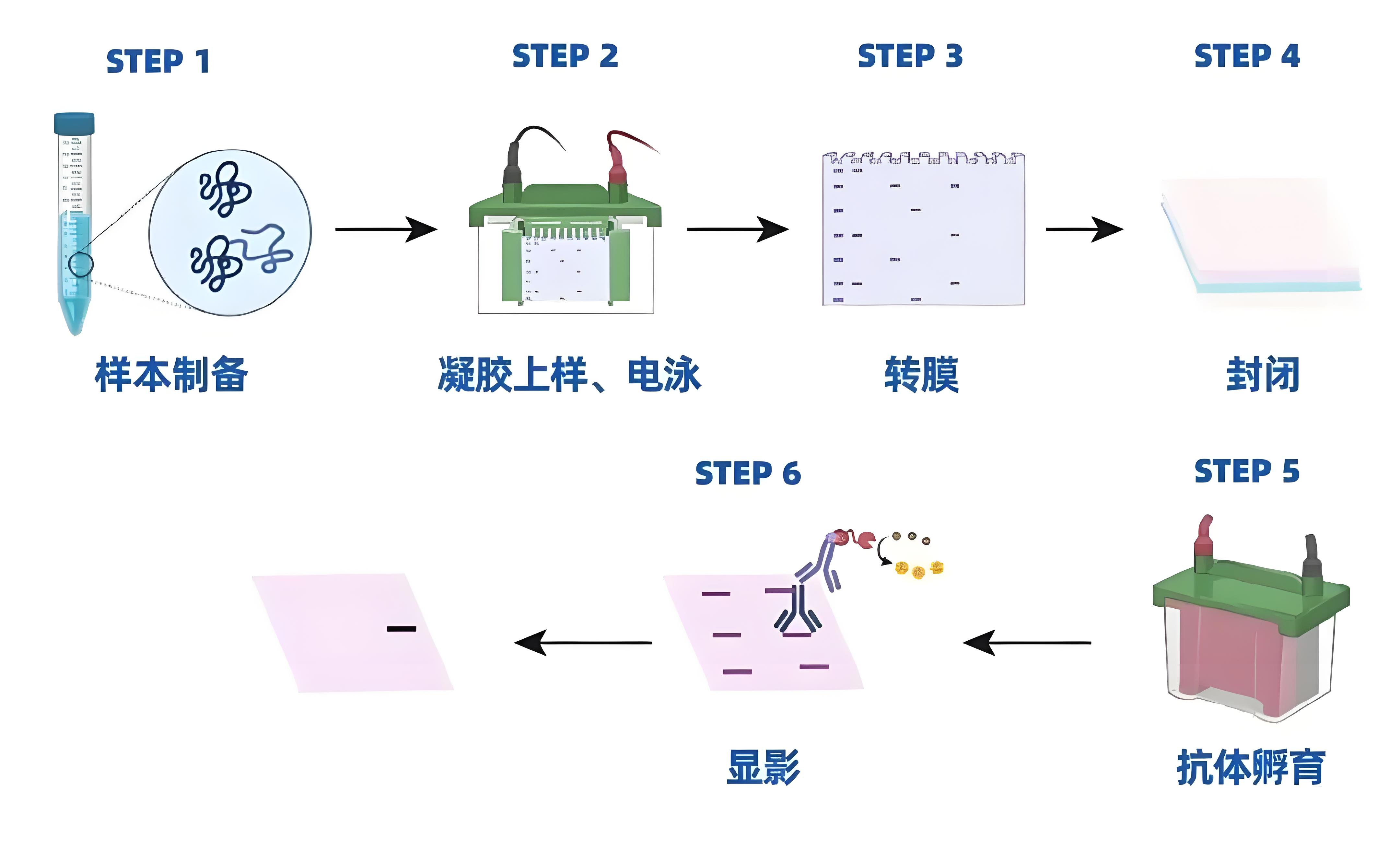
WB实验流程图
一、蛋白样本提取制备
1、总蛋白提取:
室温融解蛋白裂解液 RIPA,加入蛋白酶磷酸酶抑制剂混合物 (10X),使最终浓度为 1X,混匀,立即放置在冰上。
(2)不同样本
- 贴壁细胞: 4℃ 预冷的PBS洗 2~3 遍,用细胞刮子刮下细胞,或用胰蛋白酶处理细胞使细胞不再贴壁很紧,并用移液器吹打下细胞。离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
- 悬浮细胞:用 PBS 洗 2~3 遍,离心收集细胞,尽最大努力吸尽上清,留下细胞沉淀备用。
- 组织样品:剪取适量组织和适量混匀的蛋白裂解液于匀浆器中磨匀 (0.01 g 组织加上 50-100 μL 的蛋白裂解液),直至看不见组织块;
(3)裂解
细胞样品按 1×106 细胞数加 100 μL 裂解液,冰上裂解 30 min (或冰上裂解 5 min,超声仪冰浴超声 20 s)。组织样品转移匀浆液于 1.5 mL EP 管中,置于冰上裂解 15 min;
(4)抽提
12,000 rpm, 4℃ 离心 10 min,立即吸取上清至一预冷的 1.5 mL EP 管中,即为抽提得到的细胞浆蛋白。
2、BCA蛋白浓度测定:
(1)制备好 BSA 标准品,并将 BCA 试剂 A 液: B 液=50:1 配制适量 BCA 工作液,样品用预冷 PBS 进行稀释;
(2)将标准品和样品分别加到 96 孔板中;
(3)各孔加入 BCA 工作液,37 ℃ 孵育 30 min;
(4)酶标仪 562 nm 波长读取各孔 OD 值;
(5)根据标准曲线和使用的样品体积计算出样品的蛋白浓度。
二、电泳
1、制胶(使用预制胶板请忽略此步骤)
(1) 准备玻璃板,确保两块玻璃板下缘水平且均无豁口,安装时内短外长,用手压实玻璃板及垂直槽制胶架。
2、制样
加入 4×上样缓冲液混匀,100℃ 放置 10 min,迅速冰浴冷却;
3、跑胶
(1)根据 BCA 测定结果,目的蛋白每孔上样量 20 μg-40 μg,内参蛋白每孔上样量 5 μg-10 μg;
(2)电泳时上层胶使用低电压恒压电泳,80 V,约 30 min;
(3)溴酚蓝进入下层胶时使用高压恒压电泳,120 V,至溴酚蓝到达胶的底端处附近即可停止电泳。
三、转膜
(1) 准备转膜缓冲液:
提前配制好转移缓冲液并预冷至 4 ℃;
转膜完成后,取出 PVDF 膜,用 TBST 冲洗膜表面,进行封闭等后续步骤。
四、封闭
室温下,将转好的膜于摇床上用 5% 的脱脂牛奶 ,磷酸化蛋白检测用 5% 的 BSA缓冲液,室温封闭 1-2 h。
封闭液的主要作用是占据非目标结合位点,降低背景信号,从而提高检测的特异性和灵敏度。常用的封闭液:脱脂奶粉、牛血清白蛋白。那么封闭液应该如何选择呢?
脱脂奶粉:
- 一种常用的封闭液,适用于大多数实验条件,并且价格相对便宜。
- 使用时最好现配现用,确保其最佳效果。
- 脱脂奶粉含有大量的酪蛋白,在检测磷酸化蛋白时可能会产生高背景,此时应选择其他封闭液。
- 由于自身含有生物素,也不能用于生物素标记的抗体系统。
牛血清白蛋白(BSA):
- 一种常用的封闭液,尤其在检测磷酸化蛋白时表现出色。
- 成分单一,适用于多数情况,但不可封闭Fc受体。
注:封闭非磷酸化蛋白时,使用脱脂奶粉效果更佳。因为BSA仅含有一种蛋白质,分子量为66KDa。而奶粉则含有多种蛋白质,所以封闭作用更佳。
五、抗体孵育
(1)孵育一抗:稀释一抗 (TBST 溶解的 5 % 脱脂牛奶,磷酸化蛋白使用 TBST 溶解的 5% BSA),4℃ 过夜孵育。
(2)洗膜:按照 3 次 TBST 进行洗膜,每次 5 min。
(3)孵育二抗:一般使用 TBST 溶解的 5% 脱脂牛奶,磷酸化蛋白使用 TBST 溶解的 5% BSA 室温孵育 1-2 h。
(4)洗膜:按照 3 次 TBST,1 次 TBS 进行洗膜,每次 10 min。
抗体孵育温馨提示:
1.为减少非特异结合,可选用封闭液作为一抗和二抗的抗体稀释液。
2.一抗孵育条件推荐4°过夜,二抗孵育条件为室温,1h。
3.洗涤液推荐选用TBST缓冲液。洗涤时应保持适中的摇床速度,避免过快导致膜上的蛋白或抗体脱落,同时确保洗涤液能够充分接触到膜上的每一个角落。在洗涤过程中,适时更换新的洗涤液以确保洗涤效果。
4.洗涤过程中需要保持膜的湿润,避免膜干燥导致抗体结合力下降或蛋白变性
六、显影
(1)在避光环境中,将 ECL 化学发光试剂 A 液、B 液 1:1 配置,充分混匀;
(2)将 PVDF 膜置于化学发光成像仪载物台上;
(3)用移液器吸取适量 ECL 混合液滴在 PVDF 膜上,确保工作液均匀覆盖在整张印迹膜上;
(4)推入载物台,设置曝光时间进行图片采集 (可设置不同的曝光时间采集图像,从中选取曝光效果最佳的图像)。








 沪ICP备2022016794号-3
沪ICP备2022016794号-3